ΠΡΟΣΔΙΟΡΙΣΜΟΣ
ΤΟΥ pH ΔΙΑΛΥΜΑΤΩΝ
ΜΕ ΧΡΗΣΗ ΔΕΙΚΤΩΝ
(ΜΕΤΩΠΙΚΟ ΠΕΙΡΑΜΑ ΣΕ ΜΙΚΡΟΚΛΙΜΑΚΑ)
Α. ΕΙΣΑΓΩΓΗ
Οι «ηλεκτρολυτικοί δείκτες» είναι ασθενή οργανικά οξέα ή βάσεις. Όταν ο δείκτης ιοντιστεί, το μόριο του έχει διαφορετικό χρώμα από το ιόν του:
![]()
![]()
![]() ↔
↔ ![]() +
+ ![]()
χρώμα 1 χρώμα 2
Ανάλογα με το pH του διαλύματος επικρατεί το χρώμα 1 ή το χρώμα 2.
Για να μετρήσουμε το pH ενός διαλύματος με δείκτη,
συγκρίνουμε το χρώμα που παίρνει το διάλυμα , όταν προσθέσουμε σ’ αυτό μικρή
ποσότητα δείκτη, με το χρώμα που παίρνουν διαλύματα με γνωστή συγκέντρωση ![]() .Για μεγαλύτερη ακρίβεια μπορούμε να χρησιμοποιήσουμε
περισσότερους δείκτες ή πεχαμετρικό χαρτί, το οποίο περιέχει μίγμα δεικτών.
.Για μεγαλύτερη ακρίβεια μπορούμε να χρησιμοποιήσουμε
περισσότερους δείκτες ή πεχαμετρικό χαρτί, το οποίο περιέχει μίγμα δεικτών.
Η φαινολοφθαλεΐνη είναι άχρωμη σε pH < 8,2 και κόκκινη σε pH> 10.
H ηλιανθίνη είναι κόκκινη σε pH < 3 και κίτρινη σε pH > 4,5.
Το κυανό της βρωμοθυμόλης είναι κίτρινο σε pH < 6,3 και μπλε σε pH > 8,3. Σε ενδιάμεσες τιμές pH είναι πράσινο.
Το βάμμα του ηλιοτροπίου είναι κόκκινο σε όξινα διαλύματα και κυανό σε βασικά.
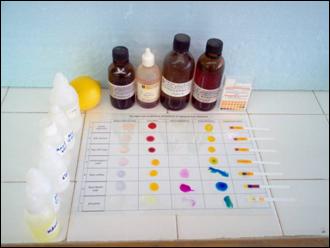 B. ΟΡΓΑΝΑ ΚΑΙ ΧΗΜΙΚΕΣ ΟΥΣΙΕΣ
B. ΟΡΓΑΝΑ ΚΑΙ ΧΗΜΙΚΕΣ ΟΥΣΙΕΣ
·
Διάλυμα ![]() 0,01 Μ (pH = 2)
0,01 Μ (pH = 2)
· Διάλυμα NaOH 0,01 M (pH = 12
· Αποσταγμένο νερό (pH = 7)
· Χυμός λεμονιού
· Διάλυμα μαγειρικής σόδας
· Διάλυμα οξικού οξέος
· Χλωρίνη
· Σταγονόμετρα
· Ηλιανθίνη
· Φαινολοφθαλεΐνη
· Κυανό βρωμοθυμόλης ή θυμόλης
· Βάμμα ηλιοτροπίου
· Πεχαμετρικό χαρτί
· Διαφάνειες
· Φωτοτυπίες πίνακα με τα υλικά και τους δείκτες
Γ. ΠΕΙΡΑΜΑΤΙΚΗ
ΔΙΑΔΙΚΑΣΙΑ
1. Μοιράζουμε σε όλους τους μαθητές από μία φωτοτυπία, μία διαφάνεια και
πεχαμετρικό χαρτί.
2. Οι μαθητές σκεπάζουν τη
φωτοτυπία με τη διαφάνεια.
3. Στάζουν με τα σταγονόμετρα ή τα σταγονομετρικά φιαλίδια λίγη ποσότητα από τις
χημικές ουσίες, στις αντίστοιχες θέσεις του
πίνακα, πάνω στη διαφάνεια.
4. Ρίχνουν λίγες σταγόνες από
τους δείκτες πάνω στις χημικές ουσίες.
5. Συγκρίνουν τα χρώματα των ουσιών, με τα αντίστοιχα χρώματα των διαλυμάτων
γνωστής συγκέντρωσης ![]() και υπολογίζουν κατά προσέγγιση το pH.
και υπολογίζουν κατά προσέγγιση το pH.
6. Βρίσκουν το pH με μεγαλύτερη ακρίβεια, συγκρίνοντας το χρώμα που παίρνει το
πεχαμετρικό χαρτί, όταν βυθιστεί στις χημικές ουσίες, με τον πίνακα χρωμάτων και
τιμών pH.
ΠΟΥΛΕΡΕΣ ΝΙΚΟΣ
ΧΗΜΙΚΟΣ